La configuración electrónica de los elementos se rige según el diagrama de Moeller.
Obtención del diagrama de Moeller:
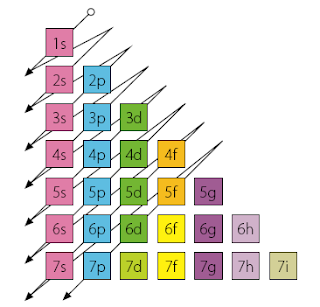 El Diagrama de Möller-Moseley recopila en una tabla una serie de datos que proporcionan los números cuánticos n (nivel de orbitales), l (tipo de orbital, s, p, d o f), m (orientación del orbital en el espacio), y s (espín, igual siempre a +1/2 ó -1/2).
El Diagrama de Möller-Moseley recopila en una tabla una serie de datos que proporcionan los números cuánticos n (nivel de orbitales), l (tipo de orbital, s, p, d o f), m (orientación del orbital en el espacio), y s (espín, igual siempre a +1/2 ó -1/2).Salvo en el caso de s, los valores de todos los números cuánticos se obtienen a partir del valor de n:
n: número cuántico principal, toma valores enteros {1,2,3,4...},ya que es el "número del nivel".
l: número cuántico, toma todos los valores enteros desde 0 hasta (n-1). Caracteriza el tipo de orbital (s, p, d o f) en función del nivel, n.
m:número cuántico, toma todos los valores enteros desde (-l) hasta (+l) (incluidos los extremos. Indica la orientación espacial del orbital, en función de l.
 |
| Orbital s |
ms: número cuántico de spín; ms= +1/2 ó -1/2 siempre; es el espín.
Así, a partir del nivel del orbital, se pueden deducir todas sus características:
n=1 (Primer nivel de orbitales):
l=0 --> Esto nos da orbitales de tipo s. Llamados s de la palabra sharp.
m=0 --> Un valor, una orientación, con lo que sólo hay un orbital tipo s en el nivel 1 (n=1). El orbital es, por lo tanto llamado 1s (se le añada como prefijo el valor de n).
ms= +1/2.
 |
| Orbital p |
l=0,1:
-l=0 nos indica orbitales tipo s, y siempre hay uno porque para l=0, m sólo tiene un valor, 0 --> El orbital es 2s.
-l=1 nos indica orbitales tipo p, y siempre hay 3, tantos como valores de m ({-1,0,+1}), y hay uno por cada dirección o eje en el espacio: 2px, 2py y 2pz. Llamados p de la palabraprincipal.
m: (ya calculado); s: (se mantiene con sus dos mismos valores, que tienen que ver con el espín de los electrones, no con los orbitales).
 |
| Orbital d |
l=0,1,2:
-l=0, como ya se calculó, nos da un orbital s--> 3s.
-l=1, como ya se calculó, da 3 orbitales p--> 3px, 3py y 3pz.
 |
| Orbital f |
n=4 (Cuarto nivel de orbitales):
l=0,1,2,3:
-l=0 --> 4s.
-l=1 --> 4px, 4py y 4pz.
-l=2 --> 4dz^2, 4dx^2y^2, 4dy^2z^2, 4dxy, 4dyz.
-l=3 indica orbitales tipo f, y hay 7, pues m=-3,-2,-1,0,+1,+2,+3, con lo que hay 7 orditales 4f. Llamados f de la palabra fundamental.
Así, y teniendo en cuenta que cada orbital tiene un máximo de 2 electrones, según el principio de exclusión de Pauli, éstos son los orbitales existentes en la configuración electrónica de los átomos, recogida en el diagrama de Möller-Moseley hasta la fecha, pero puede que en un futuro existan más orbitales.
que significa g, h, i?
ResponderEliminarquien es fede
ResponderEliminar